Фізичні властивості металів. Фізичні властивості металів - Гіпермаркет знань Фізичні властивості металів IVА групи
Всі метали та сплави металівмають певні властивості. Властивості металів та сплавівподіляють на чотири групи: фізичні, хімічні, механічні та технологічні.
Фізичні властивості. До фізичних властивостей металів та сплавіввідносяться: щільність, температура плавлення, теплопровідність, теплове розширення, питома теплоємність, електропровідність та здатність намагнічуватися. Фізичні властивості деяких металів наведені у таблиці:
Фізичні властивості металів
| Назва | Питома вага, г 1см 3 | Температура плавлення, °С | Коефіцієнт лінійного розширення, α 10 -6 | Питома теплоємність, кал/г-град | Теплопровідність λ, Кал/см сек-град | Питомий електроопір при 20°, Ом мм / м |
| Алюміній | ||||||
| Вольфрам | ||||||
| Марганець | ||||||
| Молібден | ||||||
Густина.Кількість речовини, що міститься в одиниці об'єму, називають щільністю.Щільність металу може змінюватись в залежності від способу його виробництва та характеру обробки.
Температураплавлення. Температуру, при якій метал повністю переходить із твердого стану в рідкий, називають температурою плавлення. Кожен метал чи сплав має власну температуру плавлення. Знання температури плавлення металів допомагає правильно вести теплові процеси під час термічної обробки металів.
Теплопровідність.Здатність тіл передавати тепло від більш нагрітих частинок до менш нагрітих називають теплопровідністю . Теплопровідність металу визначається кількістю теплоти, що проходить по металевому стрижню перетином 1см 2 , довжиною 1см протягом 1сек. при різниці температур 1°С.
Тепловерозширення.Нагрівання металу до певної температури викликає розширення.
Величину подовження металу під час нагрівання легко визначити, якщо відомий коефіцієнт лінійного розширення металу α. Коефіцієнт об'ємного розширення металу дорівнює β Зα.
Питоматеплоємність. Кількість тепла, яка необхідна для підвищення температури 1 гречовини на 1°С називають питомою теплоємністю. Метали в порівнянні з іншими речовинами мають меншу теплоємність, тому їх нагрівають без великих витрат тепла.
Електропровідність.Здатність металів проводити електричний струм називають електропровідністю. Основною величиною, що характеризує електричні властивості металу, є питомий електроопір ρ, тобто опір, який чинить струм дріт з даного металу довжиною 1м та перетином 1 мм 2 .Воно визначається омах. Величину, обернену питомому електроопору, називають електропровідністю.
Більшість металів має високу електропровідність, наприклад срібло, мідь та алюміній. З підвищенням температури електропровідність зменшується, і з зниженням увеличивается.
Магнітні властивості.Магнітні властивості металів характеризуються такими величинами: залишковою індукцією, коерцетивною силою та магнітною проникністю.
Залишковою індукцією (Вr) називають магнітну індукцію, що зберігається у зразку після його намагнічування та зняття магнітного поля. Залишкову індукцію вимірюють у гаусах.
Коерцетивною силою (Нс)називають напруженість магнітного поля, яка повинна бути прикладена до зразка, щоб звести до нуля залишкову індукцію, тобто розмагнітити зразок. Коерцетивну силу вимірюють у ерстедах.
Магнітна проникність μ характеризує здатність металу намагнічуватися під визначається за формулою
Залізо, нікель, кобальт і гадолиний притягуються до зовнішнього магнітного поля значно сильніше, ніж інші метали, і зберігають здатність намагнічуватися. Ці метали називаються феромагнітними (від латинського слова ферум - залізо), які магнітні властивості - феромагнетизмом. При нагріванні до температури 768 ° С (температура Кюрі) феромагнетизм зникає, і метал стає немагнітним.
Хімічні властивості.Хімічними властивостями металів та сплавів металівназивають властивості, що визначають їхнє відношення до хімічних впливів різних активних середовищ. Кожен метал або сплав металу має певну здатність чинити опір впливу цих середовищ.
Хімічні впливи середовища проявляються в різних формах: залізо іржавіє, бронза покривається зеленим шаром окису, сталь при нагріванні в загартованих печах без захисної атмосфери окислюється, перетворюючись на окалину, а в сірчаній кислоті розчиняється і т. д. Тому для практичного використання металів та сплавів необхідно знати їхні хімічні властивості. Ці властивості визначають зі зміни ваги випробуваних зразків за одиницю часу на одиницю поверхні. Наприклад, опір сталі окалиноутворенню (жаростійкість) встановлюють збільшення ваги зразків за 1 годину на 1 дмповерхні в грамах (приріст виходить за рахунок утворення оксидів).
Механічні властивості.Механічні властивості визначають працездатність сплавів металівпри вплив на них зовнішніх сил. До них відносяться міцність, твердість, пружність, пластичність, ударна в'язкість та ін.
Для визначення механічних властивостей сплавів металівїх піддають різним випробуванням.
Випробуванняна розтягування(Розрив). Це основний спосіб випробування, застосовуваний визначення межі пропорційності σ пц, межі плинності σ s, межі міцності σ b відносного подовження і відносного звуження ψ.
Для випробування на розтягування виготовляють спеціальні зразки-циліндричні та плоскі. Вони можуть бути різних розмірів, залежно від типу розривної машини, де відчувають метал на розтяг.
Розривна машина працює наступним чином: випробуваний зразок закріплюють у затискачах головок і поступово розтягують із зростаючою силою Рдо розриву.
На початку випробування при невеликих навантаженнях зразок деформується пружно, подовження його пропорційно до зростання навантаження. Залежність подовження зразка від прикладеного навантаження називають законом пропорційності.
Найбільше навантаження, яке може витримати зразок без відхилення від закону пропорційності, називають попередулом пропорційності:
σ пц = Рр/Fo
Fпро мм 2 .
У разі збільшення навантаження крива відхиляється убік, т. е. закон пропорційності порушується. До точки Р рдеформація зразка була пружною. Деформація називається пружною, якщо вона повністю зникає після розвантаження зразка. Практично межа пружності сталі приймають рівною межі пропорційності.
З подальшим збільшенням навантаження (вище точки Р е)крива починає значно відхилятися. Найменше навантаження, при якому зразок деформується без помітного збільшення навантаження, називають межею плинності:
σ s=Ps/Fo
де , Кгс;
F o - Початкова площа поперечного перерізу зразка, мм 2 .Після межі плинності навантаження збільшується до точки Ре,де вона сягає свого максимуму. Поділом максимального навантаження на площу поперечного перерізу зразка визначають межа міцності:
σb=Pb/Fo,
F o - Початкова площа поперечного перерізу зразка, мм 2 .У точці Р дозразок розривається. За зміною зразка після розриву судять про пластичність металу, яка характеризується відносним подовженням δ і звуженням ψ.
Під відносним подовженням розуміють відношення збільшення довжини зразка після розриву до його початкової довжини, виражене у відсотках:
δ= l 1 - l 0 / l 0 · 100%
де l 1 - Довжина зразка після розриву, мм;
l 0 - Початкова довжина зразка, мм.
Відносним звуженням називається відношення зменшення площі поперечного перерізу зразка після розриву до його початкової площі поперечного перерізу
φ= F o- F 1 / F 0 · 100%,
де F o - Початкова площа перерізу зразка, мм 2;
F 1 - площа поперечного перерізу зразка у місці розриву (шийка), мм 2 .
Випробування на повзучість.Повзучість - це властивість сплавів металівповільно та безперервно пластично деформуватися при постійному навантаженні та високих температурах. Основною метою випробування на повзучість є визначення межі повзучості - величини напруги, що діє тривалий час за певної температури.
Для деталей, що працюють тривалий час при підвищених температурах, враховують тільки швидкість повзучості при процесі, що встановився, і задають граничні умови, наприклад1°/о за 1000 год. або 1°/о за 10 000 год.
Випробуванняна ударну в'язкість.Здатність металів, чинити опір дії ударних навантажень ударною в'язкістю. Випробовування на ударну в'язкість в основному піддають конструкційні сталі, так як вони повинні мати не тільки високі показники статичної міцності, але і високу ударну в'язкість.
Для випробування беруть зразок стандартної форми та розмірів. Зразок надрізають посередині, щоб він у процесі випробування переломився у цьому місці.
Зразок випробовують так. На опори маятникового копра кладуть випробуваний зразок надрізом до станин . Маятник вагою G піднімають на висоту h 1 . При падінні з цієї висоти маятник вістрям ножа руйнує зразок, після чого піднімається на висоту h 2 .
За вагою маятника та висотою його підйому до і після руйнування зразка визначають витрачену роботу А.
Знаючи роботу руйнування зразка, обчислюємо ударну в'язкість:
α до=А/F
де А- робота, витрачена на руйнування зразка, кгсм;
F - площа поперечного перерізу зразка у місці надрізу, см 2 .
СпосібБрінелля. Сутність цього способу полягає в тому , що, використовуючи механічний прес, в випробуваний метал під певним навантаженням вдавлюють сталеву загартовану кульку і діаметром отриманого відбитка визначають твердість.
Спосіб Роквелла. Для визначення твердості за способом Роквелла застосовують алмазний конус з кутом при вершині 120°, або сталева кулька діаметром 1,58 мм.При цьому способі вимірюють діаметр відбитка, а глибину вдавлювання алмазного конуса або сталевої кульки. Твердість вказується стрілкою індикатора одразу після закінчення випробування. При випробуванні загартованих деталей з високою твердістю застосовують алмазний конус і вантаж 150 кгс.Твердість у цьому випадку відраховують за шкалою Зі позначають HRC.Якщо при випробуванні береться сталева кулька і вантаж 100 кгс, то твердість відраховують за шкалою Уі позначають HRB.При випробуванні дуже твердих матеріалів або тонких виробів використовують алмазний конус і вантаж 60 кгс.Твердість при цьому відраховують за шкалою Аі позначають HRA.
Деталі для визначення твердості на приладі Роквелла повинні бути добре зачищені і не мати глибоких рисок. Спосіб Роквелла дозволяє точно та швидко проводити випробування металів.
Спосіб Вікерса . При визначенні твердості за способом Вікерса як наконечник, що вдавлюється в матеріал, застосовують чотиригранну піраміду алмазу з кутом міжгранями 136°. Отриманий відбиток вимірюють за допомогою мікроскопа, що є у приладі. Потім за таблицею знаходять число твердості HV.При вимірі твердості застосовують одне з наступних навантажень: 5, 10, 20, 30, 50, 100 кгс.Невеликі навантаження дозволяють визначати твердість тонких виробів і поверхневих шарів деталей, що азотуються і ціануються. Прилад Вікерса зазвичай використовують у лабораторіях.
Спосіб визначення мікротвердості . Цим способом вимірюють твердість дуже тонких поверхневих шарів та деяких структурних складових сплавів металів.
Мікротвердість визначають приладом ПМТ-3, який складається з механізму для вдавлювання алмазної піраміди під навантаженням 0,005-0,5 кгста металографічного мікроскопа. В результаті випробування визначають довжину діагоналі одержаного відбитка, після чого по таблиці знаходять значення твердості. Як зразки для визначення мікротвердості застосовують мікрошліфи з полірованою поверхнею.
Спосіб пружної віддачі. Для визначення твердості способом пружної віддачі застосовують прилад Шора, який працює наступним чином. На добре зачищену поверхню випробуваної деталі з висоти Нпадає бойок, з алмазним наконечником. Вдарившись об поверхню деталі, бойок піднімається на висоту. h.По висоті відскакування бойка відраховують числа твердості. Чим твердіший випробуваний метал, тим більша висота відскакування бойка, і навпаки. Прилад Шора використовують переважно для перевірки твердості великих колінчастих валів, головок шатуна, циліндрів та інших великих деталей, твердість яких важко вимірювати на інших приладах. Прилад Шора дозволяє перевіряти шліфовані деталі без порушення якості поверхні, однак результати перевірки не завжди точні.
Перекладна таблиця твердості
| Діаметр відбитка (м м) по Брінеллю, діаметр кульки 10 мм, навантаження 3000 кгс | Число твердості за |
||||||
| Брінеллю НВ | Роквеллу шкали | Вікерсу HV | |||||
Спосіб дряпання.Цей спосіб, на відміну від описаних, характеризується тим, що при випробуванні відбувається не тільки пружна та пластична деформація випробуваного матеріалу, але і його руйнування.
В даний час для перевірки твердості та якості термічної обробки сталевих заготовок та готових деталей без руйнування застосовують прилад – індуктивний дефектоскоп ДІ-4. Цей прилад працює на вихрових струмах, які збуджуються змінним електромагнітним полем, яке створюється датчиками в контрольованих деталях та еталоні.
Густина.Це - одна з найважливіших характеристик металів та сплавів. за щільністю метали поділяються на такі групи:
легені(Щільність не більше 5 г/см 3) - магній, алюміній, титан та ін:
важкі- (Щільність від 5 до 10 г/см 3) - залізо, нікель, мідь, цинк, олово та ін (це найбільш велика група);
дуже важкі(Щільність більше 10 г/см 3) - молібден, вольфрам, золото, свинець та ін.
У таблиці 2 наведено значення густини металів. (Це та наступні таблиці характеризують властивості тих металів, які становлять основу сплавів для художнього лиття).
Таблиця 2. Щільність металу.
Температура плавлення.Залежно від температури плавлення метал поділяють такі групи:
легкоплавкі(температура плавлення вбирається у 600 o З) - цинк, олово, свинець, вісмут та інших.;
середньоплавкі(Від 600 o С до 1600 o С) - до них відносяться майже половина металів, у тому числі магній, алюміній, залізо, нікель, мідь, золото;
тугоплавкі(понад 1600 o С) - вольфрам, молібден, титан, хром та ін.
Ртуть відноситься до рідин.
При виготовленні художніх виливків температура плавлення металу або сплаву визначає вибір плавильного агрегату та вогнетривкого формувального матеріалу. При введенні в метал добавок температура плавлення зазвичай знижується.
Таблиця 3. Температура плавлення та кипіння металів.
Питома теплоємність. Це кількість енергії, необхідне підвищення температури одиниці маси на градус. Питома теплоємність зменшується зі збільшенням порядкового номера елемента таблиці Менделєєва. Залежність питомої теплоємності елемента у твердому стані від атомної маси описується приблизно законом Дюлонга і Пти:
m a c m = 6.
де, m a- Атомна маса; c m- Питома теплоємність (Дж/кг * o С).
У таблиці 4 наведено значення питомої теплоємності деяких металів.
Таблиця 4. Питома теплоємність металів.
Прихована теплота плавлення металів. Ця характеристика (таблиця 5) поряд з питомою теплоємністю металів значною мірою визначає необхідну потужність плавильного агрегату. Для розплавлення легкоплавкого металу іноді потрібно більше теплової енергії, ніж тугоплавкого. Наприклад, для нагрівання міді від 20 до 1133 o З потрібно в півтора рази менше теплової енергії, ніж для нагрівання такої кількості алюмінію від 20 до 710 o C.
Таблиця 5. Прихована теплота металу
Теплоємність. Теплоємність характеризує передачу теплової енергії від частини тіла до іншої, а точніше, молекулярної перенесення теплоти в суцільному середовищі, обумовлений наявністю градієнта температури. (Таблиця 6)
Таблиця 6. Коефіцієнт теплопровідності металів при 20 o
Якість художнього лиття тісно пов'язане із теплопровідністю металу. У процесі виплавки важливо не лише забезпечити досить високу температуру металу, але й досягти рівномірного розподілу температури у всьому обсязі рідкої ванни. Чим вище теплопровідність, тим більш рівномірно розподілена температура. При електродуговій плавці, незважаючи на високу теплопровідність більшості металів, перепад температури за перерізом ванни досягає 70-80 o З, а для металу з низькою теплопровідністю цей перепад може досягати 200 o З і більше.
Сприятливі умови для вирівнювання температури створюються при індукційній плавці.
Коефіцієнт теплового розширення. Ця величина, що характеризує зміну розмірів зразка довжиною 1 м при нагріванні на 1 o С має важливе значення при емальєрних роботах (таблиця 7)
Коефіцієнти теплового розширення металевої основи та емалі повинні мати по можливості близькі значення, щоб після випалу емаль не розтріскувалася. Більшість емалей, що становлять твердий коефіцієнт оксидів кремнію та інших елементів, мають низький коефіцієнт теплового розширення. Як показала практика, емалі дуже добре триматися на залозі, золоті, менш міцно – на міді та сріблі. Можна вважати, що титан - дуже потрібний матеріал для емальування.
Таблиця 7. Коефіцієнт теплового розширення металів.
Відбивна здатність. Це здатність металу відбивати світлові хвилі певної довжини, яка сприймає людським оком як колір (таблиці 8). Кольори металу вказані у таблиці 9.
Таблиця 8. Відповідність між кольором та довжиною хвилі.
Таблиця 9. Кольори металів.
Чисті метали в декоративно-ужитковому мистецтві практично не застосовуються. Для виготовлення різних виробів використовують сплави, характеристики яких значно відрізняються від кольору основного металу.
Протягом тривалого часу накопичувався величезний досвід застосування різних ливарних сплавів виготовлення прикрас, побутових предметів, скульптур та багатьох інших видів художнього лиття. Однак досі ще не розкрито взаємозв'язок між будовою сплаву та його відбивною здатністю.
По темі:
» Загальна характеристика металів. Особливості будови металів. Фізичні властивості металів. Сплави».
Вчитель хімії
МОУ «Середня загальноосвітня школа №5»
м. Івантіївки
Мета уроку:створити умови для узагальнення та поглиблення знань учнів про метали як прості речовини, фізичні властивості металів, використання людиною.
Тип уроку:Урок узагальнення та систематизація ЗУН.
Завдання уроку:
- Освітня:повторити з учнями становище металів у ПСХЕ, особливості будови їх атомів і кристалів, повторити та узагальнити відомості про металевий зв'язок та кристалічні решітки, узагальнити та розширити відомості учнів про фізичні властивості металів та їх класифікацію, дати поняття про сплави. Виховна:виховувати комунікативні якості, вміння висловлювати власну думку, співпрацю у групі. Розвиваюча:розвивати пізнавальну активність учнів, сприяти уроці розвитку умінь: спостерігати, аналізувати, порівнювати, робити висновки, і навіть формуванню навичок роботи з різними джерелами: таблицями, схемами, колекціями , опорними конспектами.
На уроці використовувалося таке обладнання:
Мультимедійний проектор Колекція «Метали та сплави» Моделі кристалічних ґрат хлориду натрію, алмазу, заліза, міді Таблиця металевих кристалічних ґрат ПСХЕ
Хід уроку.
Організаційний момент .Вчитель повідомляє мету уроку, відзначаючи практичну важливість металів у житті.
2.Перевірка домашнього завдання.
Перевірка першої частини будинку. завдання (2 учні біля дошки)
Зобразити будови атомів: 1) Na, Mg, Al; 2) Li, Na, K
3.Фронтальне опитування.
Де в Періодичній системі є елементи-метали? У чому полягає особливість будови елементів-металів?
Чому Sn, Pb, Bi, Po, атоми яких містять 4,5,6 електронів, є металами?
Відповідь: Порівняно великий радіус (висновок, який і вирішив проблему; у підтвердженні цього вчитель наводить приклад-бор, атоми якого мають 3 електрони на зовнішньому рівні, але маленький радіус атома є типовим неметалом).
Слухаємо відповіді учнів, які виконували домашнє завдання біля дошки.
Потім продовжуємо розмову.
Як у періоді зі зростанням порядкового номера змінюються металеві властивості? і чому? Як у групах основних підгруп з зростанням порядкового номера змінюються металеві властивості? і чому?
Запис у зошит:
1) Метали на останньому рівні мають невелику кількість електронів (1-3)
2) Оскільки метали розташовані на початку періоду, то вони мають великий атомний радіус.
Вчитель: Слід зазначити, що розподіл елементів на метали та неметали умовне. Наприклад, алотропні модифікації олова: a(Sn) або сіре олово-неметал, а b(Sn) або біле олово-метал (при t<+13,20С белое олово рассыпается в серый порошок),). Ребята вспоминают название этого явления-»оловянная чума».
Метал германій має багато неметалевих властивостей; хром, алюміній та цинк-типові метали, але утворюють сполуки сполуки (KAlO2, K2ZnO2, K2Cr2O7), у яких виявляють неметалічні властивості. Йод і графіт-типові неметали, але мають властивості, властиві металам (металевий блиск).
4.Особливості кристалічних металевих ґрат і металевого зв'язку. Фізичні властивості металів.
Таблиця «Металеві грати»

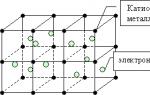
Вчитель: Хлопці, давайте згадаємо природу металевого зв'язку та особливості металевих кристалічних ґрат.
За таблицею хлопці згадують, що у вузлах ґрат знаходяться позитивні іони та атоми металів, а по всьому об'єму кристала металу в постійному русі узагальнені електрони (електронний «газ»).
Вчитель нагадує учням, що позитивні іони та атоми постійно переходять один в одного завдяки вільному переміщенню електронів. При приєднанні електрона до іону, останній перетворюється на атом, а атом у свою чергу на іон. Ці процеси протікають безперервно, згідно зі схемою: Ме0- n««Men+
Потім робиться висновок:
Металевий зв'язок(МС)- це зв'язок, що виникає в кристалах металів (сплавів) внаслідок електростатичної взаємодії позитивно заряджених іонів металу та негативно заряджених електронів.
Вчитель запитує: Які види хімічного зв'язку відомі? Учні відповідають (іонна, ковалентна). Щоб визначити риси подібності та відмінності металевого зв'язку з цими видами зв'язку, перевіряється друга частина домашнього завдання.
Перевірка другої частини домашнього завдання (3 учні біля дошки):
Записати схему утворення хімічного зв'язку для речовин із формулами:
1) NaCl 2) HCl 3) Cl2
Клас у цей час відповідає на запитання:
· Які види хімічного зв'язку вам відомі?
· Який зв'язок називається іонним?
· Який зв'язок називається ковалентним?
· Який зв'язок називається ковалентною полярною? Неполярний?
Потім ведеться бесіда, в результаті якої учні порівнюють, аналізують та узагальнюють знання про будову. Приходять до висновку:
Подібність: а) з іонноюзв'язком МС подібна до наявності іонів;б) з ковалентноюзв'язком МС має схожість, оскільки в її основі
лежить узагальнення електронів.
Відмінність:а) в металах позитивно заряджені іони утримуються електронами, що вільно переміщаються, а в речовинах з іонноїзв'язком негативними іонами.б) електрони, які здійснюють ковалентну зв'язь, що знаходяться поблизу з'єднаних атомів і міцно з ними пов'язані, а електрони, що здійснюють МС, вільно переміщаються по всьому кристалу і належать до всіх його атомів.
Вчитель обов'язково «наголошує», що МС існує тільки в металах, що знаходяться в рідкому та твердому стані; але не в молекулах, що утримуються ковалентними зв'язками - у парах (газоподібний стан) метали існують у вигляді молекул з цим типом зв'язку: Li2, Na2.
Обговорення питання про властивості металів, робота з колекцією «Метали та сплави».
Під час обговорення учні питання вчителя: «Які загальні властивості притаманні металам і чому?» Відповідають: 1) Блиск, електропровідність, теплопровідність,
пластичність.
2) Загальні фізичні властивості металів визначаються металевим зв'язком та металевою кристалічною решіткою.
5. Пояснення нового матеріалу.
5.1. Фізичні властивості металів.
Вчитель наголошує, що фізичні властивості металів визначаються їх будовою .
|
|
1) Твердість. Усі метали, крім ртуті, тверді. Але це властивість по-різному у кожного металу.
Рис.1 Відносна твердість деяких металів
Найм'якіші метали-натрій, калій, індій, їх можна різати ножем; найтвердіший метал-хром, дряпає скло.
2.Щільність. Усі метали поділяються на легкі (зі щільністю до 5г/см3) та важкі (зі щільністю більше 5г/см3).
Легкі:Li,Na,K,Mg,Al Важкі:Zn,Cu,Sn,Ag,Au
Щільність найлегшого металу літію дорівнює 0,53 г/см3, тобто даний метал майже в 2 рази легший за воду. Найважчий метал-це осмій, його щільність дорівнює 22,6 г/см3.

Щільність деяких речовин
3. Плавкість.
Метали діляться на легкоплавкі та тугоплавкі.

Мал. 3 Температура плавлення деяких речовин
4. Електропровідність.
Метали мають електричну провідність завдяки наявності вільних електронів або електронного «газу». Найкращі провідники-срібло, мідь, золото, алюміній, залізо. Найгірші провідники-ртуть, свинець, вольфрам.
Електрони, що хаотично рухаються в металі, під впливом прикладеної електричної напруги набувають спрямованого руху, в результаті чого виникає електричний струм.
При підвищенні температури металу зростають амплітуди коливань атомів та іонів, що знаходяться у вузлах кристалічних ґрат. Це ускладнює рух електронів, електрична провідність падає.
При знижених температурах коливальний рух зменшується, тому електрична провідність різко зростає. Графіт (неметал) за низьких температур електричний струм не проводить через відсутність електронів. А при підвищенні температури ковалентні зв'язки руйнуються і електрична провідність починає зростати.
5.Теплопровідність.
Теплопровідність металів, як правило, відповідає електропровідності. Вона обумовлена великою рухливістю вільних електронів, які, зіштовхуючись з іонами і атомами, що коливають, обмінюються з ними енергією. Тому відбувається швидке вирівнювання температури по всьому шматку металу. Найкраща провідність у срібла, міді, найгірша - у вісмуту, ртуті.
6. Пластичність.
Метали мають пластичність, ковкість і міцність. Завдяки вільному переміщенню електронів по всьому кристалу розрив зв'язків не відбувається, тому що окремі шари кристалі можуть зміщуватися відносно один одного. Це надає металам пластичність-Здатність змінювати свою форму без розриву хімічних зв'язків. (Досвід: дві скляні пластинки ковзають легко відносно один одного, але важко відриваються. Прошарок води-електронний газ).
Якщо зробити подібний вплив на кристал з ковалентним зв'язком, відбудеться розрив хімічних зв'язків і кристал зруйнується, тому неметали крихкі.
Метали, що мають високу пластичність-золото, срібло, мідь, олово, залізо, алюміній.
|
|

Рис.4. Зміщення шарів у кристалічних решітках при механічному впливі:
а) у разі металевого зв'язку; б) у разі ковалентного зв'язку
7. Металевий блиск.
Для всіх металів характерний металевий блиск: сірий колір чи непрозорість. Вільні електрони, що заповнюють міжатомний простір у ґратах, відбивають світлові промені, тому метали мають металевий блиск (сріблясто-білий та сірий). Тільки золото та мідь більшою мірою поглинають короткі хвилі (близькі до фіолетового кольору) і відбивають довгі хвилі світлового спектру, тому мають жовтий та оранжевий колір.
Найблискучіші метали-ртуть, срібло. У порошку всі метали, крім алюмінію та магнію, втрачають блиск і мають чорний або темно-сірий колір.
5.2 Сплави.
5.2.1. Вчитель: Чому хімічно чисті метали рідко використовуються у побуті та промисловості? Наприклад, із міді не роблять побутові вироби (як із алюмінію). Легкий та міцний кальцій не використовують у літакобудуванні? Навіть золоті прикраси, крім золота, містять мідь, срібло.
Учні висловлюють свої пропозиції, під час яких робиться висновок: У техніці використовують переважно сплави, а не чисті метали, тому що метали окремо не мають усіх властивостей, які необхідні для практичного застосування.
Запис у зошит:
Сплави металів-Речовини з металевими властивостями, що складаються з двох або декількох компонентів, один з яких обов'язково-метал.
У сплавах, як і в металах, хімічна зв'язок-металлическая. Тому фізичні властивості сплавів-електропровідність. теплопровідність, пластичність, металевий блиск (відповідають учні).
При отриманні металу вихідні речовини розплавляють і перемішують. При охолодженні відбувається кристалізація з утворенням металу. Кристалізація- це перехід речовини з рідкого стану у твердий.
Представники сплавів: робота з колекцією.
Чавун -сплав на основі заліза, що містить від 2 до 4,5% вуглецю, а також марганець, кремній, фосфор та сірку. Чавун значно твердіший заліза, дуже тендітний, не кується, а при ударі розбивається. Цей сплав застосовується виготовлення масивних деталей (так званий ливарний чавун) і як сировина для отримання сталей (так званий передільнийчавун).
Сталь - сплав на основі заліза, що містить менше ніж 2 % вуглецю. Сталі за складом ділять на два основні види : вуглецева та легована.
5.2.1. Повідомлення учнів про сплави, що використовуються в сучасній техніці, при цьому не торкаючись тих, про які йтиметься далі, у зв'язку з вивченням конкретних металів.
6. Висновок уроку.
Вчитель підбиває підсумки уроку. Дякує учням. Виставляє позначки.
7. Домашнє завдання.
§5, упр.1-3, §7, упр.1,2,4 (усно), повт. за конспектами 8 кл. (Взаємодія кислот з металами). Дайте відповідь на запитання: у яких відомих вам реакціях беруть участь метали?


- актуалізувати знання про становище металів у періодичній системі, зміну відновлювальних (металевих властивостей) металів за періодами та групами; виявити особливості будови атомів металів та риси їх відмінностей з неметалами; ознайомити із біологічною роллю хімічних елементів металів;
- простежити залежність між будовою кристалічних ґрат і фізичними властивостями металів;
- розвивати інтелектуальні та когнітивні компетенції (аналіз, порівняння, виділення головного, узагальнення, систематизація) на прикладі впливу будова – властивості, властивості – застосування; сприяти формуванню інформаційних та комунікативних компетенцій; удосконалювати навички самостійної роботи з інформацією;
здійснювати моральне та патріотичне виховання.
Тип уроку: Вивчення нового матеріалу.
Технологія: розвиток критичного мислення через читання та письмо.
Методи: словесні, наочні, практичні. Обладнання: електронна презентація (Додаток 1
- ) та необхідне для її демонстрації обладнання; дидактичні роздаткові матеріали кожного учня: тексти: «Метали. Будова кристалів металів», «Загальні фізичні властивості» ();
- Додаток 2 таблиця «Вплив типу кристалічних ґрат металу на його властивості» (),
- Додаток 3 таблиця «Залежність фізичних властивостей металів від будови металевих кристалічних ґрат» (),
- Додаток 4 кластер «Метали – прості речовини» (),
- Додаток 5 контрольний тест ()
- Додаток 6
на кожен стіл штатив із номерними пробірками: №1 – гранули алюмінію, №2 – гранули олова, №3 – гранули цинку, № 4 – порошкоподібне залізо, № 5 – порошкоподібний алюміній.
Хід уроку
I. Виклик (розмова з питань)
Хлопці, що таке визначна пам'ятка? Які визначні пам'ятки є в Росії? Навчальним пропонується подивитися відеоряд із трьох російських пам'яток і назвати їх. Що ви знаєте про ці пам'ятники? (Демонстрація слайдів 1–4 (Додаток 1
)). Показ слайдів супроводжується короткою довідкою про історію їх створення та авторів.
Що спільного у визначних пам'яток? (Виготовлені з одного металу, точніше сплаву – бронзи).
Демонстрація слайдів 6–7 (Додаток 1). «Уявлення про метали». Бесіда з учнями з питань:
Як змінилися уявлення про метали у наш час?
У яких смислових значеннях нині вживається слово метали? (хімічні елементи та прості речовини)
Що у рамках поняття метали – хімічні елементи? (Демонстрація слайду № 8 (додаток 1))
Де у періодичній системі знаходяться хімічні елементи металу?
Які особливості будови атомів металів ви знаєте з курсу хімії 8 класу?
ІІ. Осмислення.
1. Особливості будови атомів металів. Поширення хімічних елементів металів у земній корі. (Самостійна робота учнів з текстом за стратегією «Читання тексту з позначками» за варіантами (все, що викликає труднощі в тексті відзначити знаками питання, вчитель, проходячи по рядах, надає допомогу, якщо виникають труднощі)
Слайд 9 (додаток 1):
Варіант 1.
Прочитайте текст останнього абзацу на стор. 103 та перший абзац на стор. 104. Дайте відповідь на запитання: які особливості будови притаманні атомам металів? (Підручник Г. Е. Рудзітіс, Ф. Г. Фельдман Хімія 9 М.: Просвітництво 2008 - 2010)
Варіант 2.
Прочитайте 1 абзац §35 (стор. 104 – 105), розберіть схему 12. Дайте відповідь на запитання: в якому стані зустрічаються метали в природі? (Підручник Г. Е. Рудзітіс, Ф. Г. Фельдман Хімія 9 М.: Просвітництво 2008 - 2010)
Розмова щодо виконаної самостійної роботи. Узагальнення прочитаного, демонстрація слайду №10 (додаток 1).
2. Біологічна роль металів.
Робота зі слайдом № 11 (додаток 1) "Біологічна роль металів" (фронтально), демонстрація слайду № 12 "Хімічні елементи метали в організмі людини" (фронтально).
3. Контрольне тестування 1А, 2А, 3А, 4В. (Індивідуальна самостійна робота, слайд 13 (додаток 1))
4. Металеві кристалічні грати та металевий зв'язок. Різновиди кристалічних ґрат металів.
Самостійна робота з текстом «Метали. Будова кристалів металів» та §36 підручника зі стратегії «Паралельні тексти» ( Додаток 2). Заповнення таблиці «Вплив типу кристалічних ґрат металу на його властивості» ( Додаток 3). (Слайди 14–15 (додаток 1))
5. Фізичні властивості металів.
Заповнення таблиці «Залежність фізичних властивостей металів від особливостей будови металевих кристалічних ґрат», заповнення кластера «Метали – прості речовини». Слайди 16–18 (додаток 1).
6. Контрольне тестування 5А, 6А. 7А, 8А (слайд 19 додаток 1). Перевірка тесту (слайд 20 додаток 1)
7. Домашнє завдання: §34, 1 абзац §35, §36 (слайд 21 додаток 1).
ІІІ. Рефлексія
1. Твір синквейну (слайд № 22 додаток 1).
- Перший рядок – іменник;
- Другий рядок – два прикметники;
- Третій рядок – три дієслова;
- Четвертий рядок –пропозиція (афоризм), що відображає суть предмета
- П'ятий рядок – одне слово (почуття, особисте ставлення до предмета)
2. Рефлексивний тест (слайд № 23 додаток 1): (У разі своєї згоди із затвердженням поставте знак + поруч із номером затвердження.)
- Я дізнався на уроці багато нового.
- Мені це знадобиться у житті.
- На уроці було чим подумати.
- На всі запитання, що виникли у мене під час уроку, я отримав(ла) відповіді.
- На уроці я попрацював(а) сумлінно і мети уроку досяг(ла)
Використана література
- Богданова Н.А.